Wissenschaftler entdecken strukturelle basis für die SARS-CoV-2-Hemmung durch Remdesivir

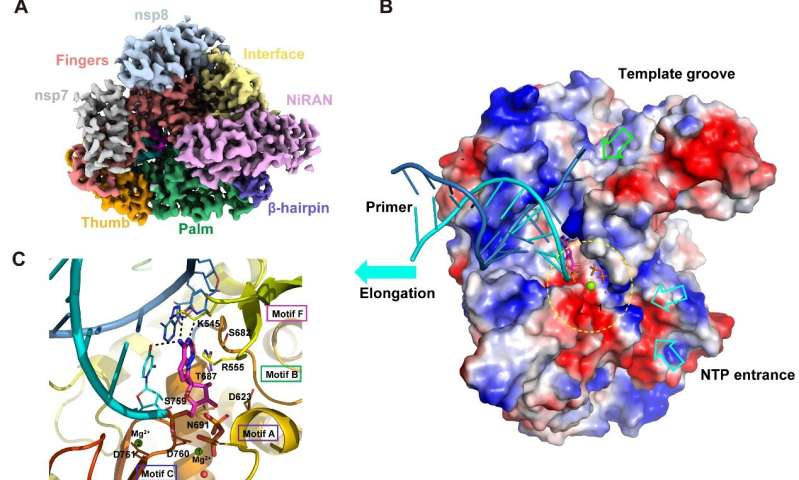
Ein team chinesischer Wissenschaftler haben berichtet, dass der hochauflösenden Kryo-EM-Struktur des Remdesivir-gebundenen RNA-replikase-Komplex aus SARS-CoV-2, das infektiöse virus von COVID-19.
Die Forschung, online veröffentlicht in der Wissenschaft am 1. Mai wurde unter der Leitung von Prof. Xu Huaqiang und Prof. Xu Yechun vom Shanghai Institute of Materia Medica (SIMM) der chinesischen Akademie der Wissenschaften (CAS), Prof. Zhang Yan von der Zhejiang University School of Medicine, Prof. Zhang Shuyang aus Peking Union Medical College und der chinesischen Akademie der Medizinischen Wissenschaften und Ihre Helfershelfer.
COVID-19 hat sich schnell auf der ganzen Welt und ist eine anhaltende humanitäre Krise. Viele Länder stehen nun vor gewaltigen Herausforderungen im Kampf gegen die SARS-CoV-2. Finding eine effektive Behandlung ist eine sehr dringende Angelegenheit.
SARS-CoV-2 ist eine positiv-Strang-RNA-virus, infiziert vor allem menschliche Zellen durch die Schleimhaut-system. Die massive Replikation des virus erfordert die schnelle Synthese seiner genetischen RNA. Dieser Prozess wird vermittelt durch eine multi-Untereinheit-Replikation Transkription Komplex, der aus mehreren nicht-Strukturproteine (nsp) des virus. Das Kernelement ist die replikase-Komplex, der die core-Komponente von coronavirus-Replikation. Zahlreiche Nukleosid-Medikamente, die auf replikase sind derzeit in der klinischen Prüfung, einschließlich Remdesivir.
Nach 46 Tagen harter Arbeit, konnten die Wissenschaftler zu erarbeiten, die replikase-targeting-Mechanismus der antiviralen Wirksamkeit dieser Nukleosid-Drogen. Ihre Studie berichten die cryo-EM Struktur des SARS-CoV-2 replikase sowohl in der apo-form at 2.8 Å resolution und im Komplex mit einem template-primer-RNA und Remdesivir bei 2,5 Å Auflösung. Die gesamte Konformation der komplexen Struktur ist sehr ähnlich wie die apo-form, mit der identischen Strukturen auf der Kern katalytisch aktive Website. Umfassende Analyse der Strukturen zeigte sich, dass die SARS-CoV-2 replikase-Komplex ist ein sehr effizientes Enzym. Während der RNA-Erweiterung, Konformationsänderung ist klein, das erklärt auch die hoch ansteckende Natur von SARS-CoV-2.
Der replikase-Komplex erkennt die RNA, aber nicht DNA—durch eine Sequenz-unabhängige Bindung Weg. Die Struktur des Komplexes erklärt, wie Remdesivir betritt die Replikation der active site und kovalent links mit dem viralen Genom, wodurch die Hemmung der virus-Replikation.
Die Reste involviert in der RNA-Bindung sowie solchen, die aus katalytisch aktive Website sind hoch konserviert unter den meisten RNA-Viren. Dies zeigt die konservative Mechanismus der replikase-Komplex während der gen-Replikation und schlägt vor, kann es möglich sein, zu entwickeln breites Spektrum antiviraler Hemmstoffe.