Wie das Gehirn und die Arterien kommunizieren liefern Blut zu Bereichen erhöhter neuronaler Aktivität

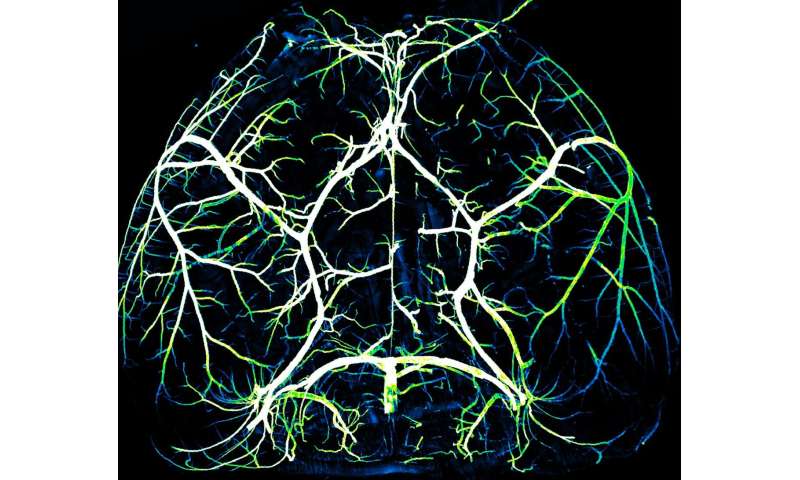
Das Gehirn ist ein gefräßiger Orgel. Ein drei-Pfund-Erwachsenen menschlichen Gehirn verbraucht etwa ein Fünftel der Körper die Energie, doch kann es nicht speichern die Energie auf seine eigene, und erfordert eine ständige Ernährung von den Herz-Kreislauf-system. Die Orgel, den Energiebedarf schwanken stark in Abhängigkeit von neuronaler Aktivität und ausreichend Blut geliefert werden muss, an der richtigen Stelle zu genau der richtigen Zeit, um eine gesunde Funktion des Gehirns.
Um diese sich ständig verändernden Anforderungen, ein Prozess, bekannt als neurovaskuläre Kopplung schnell erhöht den Blutfluss zu Bereichen erhöhter neuronaler Aktivität. Dieser Prozess beeinträchtigt ist, in den Bedingungen wie Bluthochdruck, diabetes und Alzheimer-Krankheit, und dient auch als Grundlage für bildgebende Technologien wie fMRI, was nutzt den Blutfluss wie eine Anzeige für die Aktivität des Gehirns.
Trotz seiner Bedeutung, es war unklar, wie das Gehirn und die Blutgefäße, die Kommunikation zu ermöglichen, neurovaskuläre Kopplung. Nun, in einer Studie veröffentlicht in der Natur am Feb. 19, Harvard Medical School Neurowissenschaftler berichten die Entdeckung eines Mechanismus zur Kontrolle der in den Gehirnen von Mäusen, sorgt für ausreichende Durchblutung zu Bereichen erhöhter neuronaler Aktivität in einen schnellen und präzisen Art und Weise.
Ihre Experimente zeigen, dass die Arterien im Gehirn aktiv regulieren die neurovaskuläre Kopplung in Reaktion auf die neuronale Aktivität, und dass das protein Mfsd2a, zuvor verwickelt als ein Schlüssel-regulator der schützenden Blut-Hirn-Schranke, ist von entscheidender Bedeutung für diesen Prozess. Die Ergebnisse werfen Licht auf die Mechanismen, mit denen neue Wege für die Studie in der Rolle der neurovaskulären Kopplung bei neurologischen Erkrankungen.
„Wir haben jetzt einen festen Griff auf die Mechanismen der neurovaskulären Kopplung, einschließlich seiner molekularen, zellulären und subzellulären Komponenten, die wir zuvor nie hatten“, sagte senior Studie Autor Chenghua Gu, professor von Neurobiologie in der Blavatnik-Institut an der HMS und ein Howard Hughes Medical Institute der Fakultät Gelehrten.
„Das bringt uns in eine position zu sezieren dieses Prozesses und bestimmen, zum Beispiel, ob die neurovaskuläre Kopplung Beeinträchtigungen, die wir sehen, in der Krankheiten wie Alzheimer sind das Ergebnis einer Pathologie oder die Ursache,“ Gu sagte.
Kitzelnde schnurrhaare
In früheren Studien, Gu und Kollegen gezeigt, dass die schützende Integrität der Blut-Hirn-Schranke ist gewährleistet durch das protein Mfsd2a, die unterdrückt die Bildung von caveolae—kleine lipid-Bläschen enthaltende signalgebende Moleküle—von Kapillaren in das Gehirn von Mäusen.
Zu Ihrer überraschung fanden Sie heraus, dass die Arterien, die Nährstoff-Reiches Blut von den Lungen und rund fünf Prozent der Blutgefäße im Gehirn, die entgegengesetzte Eigenschaften wie Kapillaren. Arterien fehlte Mfsd2a und stellte hohe Mengen von caveolae.
In der aktuellen Studie, die das team untersucht diese Beobachtung. Angeführt von co-ersten Autoren Brian Chow-Chow und Vicente Nunez, HMS research fellows in Neurobiologie, die Forscher stimulierten den Schnurrhaaren wach, gesunde Mäuse und gleichzeitig zu Leben-bebildert der Tiere die Aktivität des Gehirns mit Hilfe einer leistungsstarken Technik, bekannt als 2-Photonen-Mikroskopie.
In Reaktion auf whisker-stimulation, normale Mäuse zeigten eine erhöhte neuronale Aktivität, arterielle Durchmesser und der Blutfluss in den entsprechenden sensorischen Bereich des Gehirns. Jedoch Mäuse, die genetisch entwickelt, um Mangel caveolae hatte das gleiche neuronale Aktivität jedoch deutlich reduziert, die Durchblutung und die arterielle Dilatation, die angibt, Defizite in der neurovaskulären Kopplung.
Das team spezifisch blockiert Endothelzellen bilden die Auskleidung der Arterien die Bildung von caveolae, von zwingen, diese Zellen exprimieren normalerweise abwesend Mfsd2a. Dies führte erneut zu erheblichen Beeinträchtigungen der neurovaskulären Kopplung, die die Bedeutung von caveolae in den Arterien.
Zusätzliche Experimente zeigen, dass die einzigartige Rolle der arteriellen Endothelzellen. Es war zuvor bekannt, dass die neuronale Aktivität entspannt die glatten Muskelzellen umgeben, die Arterien, das führt zu Schiff-Dilatation und erhöhter Blutfluss. Im Gegensatz dazu, die Ergebnisse der aktuellen Studie zeigten einen anderen Mechanismus in die caveolae in arteriellen Endothelzellen aktivieren neurovaskulären Kopplung durch die Weiterleitung des Signals zum entspannen von Neuronen und glatten Muskelzellen.
„Seit über einem Jahrhundert, haben wir bekannt, dass dieses Phänomen existiert, wo die neuronale Aktivität rapide erhöht den Blutfluss in eine sehr lokale und zeitlich präzise Art und Weise,“ Chow sagte. „Aber die Mechanismen, wie das Nervensystem Gespräche in das Gefäßsystem der Koordination dieser Veranstaltung waren weitgehend unbekannt, und es war äußerst überraschend zu finden, dass arterielle Endothelzellen spielen eine so aktive Rolle in dem Prozess.“
Präzisions-Verbrauch
Das team entdeckte auch, dass caveolae funktioniert unabhängig von nitric oxide signaling—eine wichtige systemische Weg, der regelt, Erweiterung der Blutgefäße, das so gezielt durch Medikamente wie nitroglycerin bei Herzinsuffizienz oder sildenafil (Viagra) bei erektiler Dysfunktion.
Wenn beide caveolae und nitric oxide signaling wurden gesperrt, das team sah ein vollständiges fehlen der neurovaskulären Kopplung. Jede mechanik scheint zu spielen eine ebenso wichtige, aber unabhängige Rolle bei der Regulierung der Durchblutung in Antwort auf neuronale Aktivität. Dieses Ergebnis deutet darauf hin, dass die caveolae in den Arterien verantwortlich sein kann für gezieltere erhöht die Durchblutung, während Stickoxid wirkt mehr breit, so die Autoren.
Gu und Kollegen untersuchen jetzt die genaue Zusammensetzung der signaling-Moleküle enthalten in caveolae, um diesen Prozess besser zu verstehen. Die Forscher sagten, Sie hoffen, dass die neu offenbarte mechanistischen Grundlagen der neurovaskulären Kopplung ermöglichen wird, neue experimentelle Ansätze zur Untersuchung der Biologie dieser Prozess und wie geht es schief, bei Krankheit.
„Wir festgestellt haben, eine sehr mächtige Sammlung von genetischen Werkzeugen, die es uns ermöglichen, nicht nur identifizieren, sondern Manipulation der molekularen Mechanismen, die im Herzen der neurovaskulären Kopplung,“ Gu sagte. „Das ist wichtig angesichts der Tatsache, wie viele Aspekte der neurovaskulären Kopplung sind noch unklar.“