Protein-aggregation: Protein-Baugruppen relevant nicht nur für neurodegenerative Erkrankungen

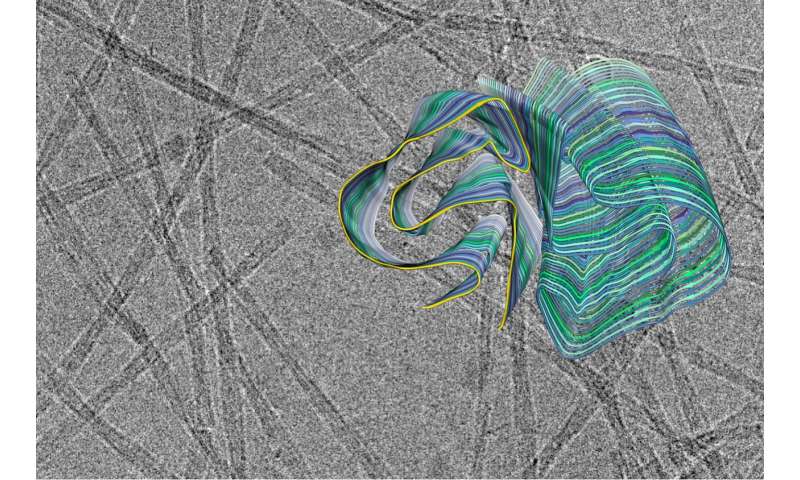
Amyloid-Fibrillen spielen eine entscheidende Rolle bei neurodegenerativen Erkrankungen. Wissenschaftler von der Heinrich-Heine-Universität Düsseldorf (HHU ein) und das Forschungszentrum Jülich haben jetzt schon die Kryo-Elektronenmikroskopie (Kryo-EM) zu Dekodieren, die die räumliche Struktur der Fibrillen gebildet, die sich aus PI3K-SH3-Domänen—ein wichtiges Modell-system für die Forschung. Obwohl die Fibrillen untersucht, die nicht selbst angeschlossen ist, mit einer Krankheit, die gewonnenen Erkenntnisse und entwickelten Methoden dienen könnten, zu verstehen, Krankheiten wie Alzheimer und Parkinson.
Proteine sind zentrale Bestandteile der lebendigen material. Diese komplexen Moleküle, die aus Kombinationen der einzelnen Aminosäuren in einigen Fällen bestehen aus tausenden von einzelnen Atomen und hat eine komplexe dreidimensionale Formen. Der Begriff ‚Fach‘ wird verwendet zur Beschreibung dieser Struktur. Die Faltung eines proteins bestimmt seine biologische Funktion.
Fehlfaltung in nicht-natürlicher Strukturen und eine damit verbundene aggregation macht Proteine nicht nur nutzlos, sondern auch potentiell giftig. Die aktuelle Ansicht ist, dass viele neurodegenerative Erkrankungen werden ausgelöst durch fehlgefaltete Proteine. Sie bilden Ablagerungen in kritischen teilen des zentralen Nervensystems. Zunächst, fibrilläre Strukturen, so genannte amyloid-Fibrillen,‘ form. Größere Ablagerungen wie amyloid-Fibrillen bilden die typischen plaques, die sich in das Gehirngewebe und kann einschränken, beschädigen oder töten Nervenzellen.
Die PI3K-SH3-Domänen sind in der Regel Bestandteil eines größeren Proteinen, können aber auch vorhanden sein, allein in Ihrer richtig gefalteten form. Sie spielen eine wichtige Rolle in der zellulären Kommunikation. Seit vielen Jahren, diese Domänen wurden als Modell-Systeme zur Untersuchung der protein-Faltung und damit die Ermittlung der Ursachen der fehlfaltung. Dieses ist, weil Forscher haben entdeckt, dass diese domains können auch die form der amyloid-Fibrillen, die unterscheiden sich nicht von den Fibrillen typisch für Krankheiten und sind nur als giftig zu den Zellen. In der Tat, alle Proteine können potenziell in form von amyloid-Fibrillen; gesunde Organismen sind aktiv und ständig gegen diesen Prozess.
Viele grundlegende Entdeckungen von amyloid-Fibrillen, die unmittelbar anwendbar sind, um Krankheit-verbundene Proteine wurden mit diesem Modell. „Aber was wir nicht wissen, bis jetzt war die genaue dreidimensionale Struktur der Fibrillen von der PI3K-SH3-Domänen“, erklärt Prof. Dr. Gunnar Schröder, Professor für Computergestützte strukturbiologie an der HHU ein, sowie arbeiten, Gruppenleiter am Forschungszentrum Jülich.
„Nun können wir die Kryo-EM zu verstehen, diese Strukturen vollständig“, ergänzt Prof. Dr. Alexander Büll, entsprechenden Autor neben Schröder der Studie, die in Nature Communications. Büll wurde ein Assistent Professor an der HHU ein bis Anfang 2019 und ist jetzt ein Professor in der Abteilung von Biotechnologie und Biomedizin an der Technischen Universität von Dänemark in Lyngby. Sprechen über die Bedeutung dieser bestimmt die Struktur, Prof. Schröder fügt hinzu: „Jetzt, da wir wissen, wie die räumliche Struktur, die viel von der früheren Daten aus den letzten 20 Jahren werden neu interpretiert, oder interpretiert mehr quantitativ.“