Veränderungen im Chromosom caps kann ein marker für tumor-Aggressivität bei Neurofibromatose Typ 1

Forscher an der Johns Hopkins Kimmel Cancer Center berichten, dass Ihre Studie über tumor-Proben von Menschen mit seltenen genetischen Syndrom Neurofibromatose Typ 1 (NF1) entdeckt hat, neuartige molekulare Hinweise über die Tumoren sind die meisten wahrscheinlich, aggressiv zu sein bei Patienten mit NF1. Nach Angaben der Forscher, die Hinweise vorrücken konnten, die Suche nach mehr individuellen und relevanten Behandlungen, die Freizeit-Patienten die Exposition gegenüber Behandlungen unwahrscheinlich, um zu arbeiten.
„Manche NF1-Tumoren sind schwer zu klassifizieren als gutartig oder bösartig“, sagt Studienleiter Fausto Rodriguez, M. D., außerordentlicher professor der Pathologie, Onkologie und Augenheilkunde an der Johns Hopkins University School of Medicine und ein Mitglied der Johns Hopkins Kimmel Cancer Center. „Eine andere molekulare marker zur Bewertung wird uns helfen, bessere Vorhersagen über die Ergebnisse der Behandlung.“
Eine Zusammenfassung der Studie wurde online veröffentlicht in der Zeitschrift Acta Neuropathologica Communications am Aug. 28.
NF1 ist verursacht durch Mutationen im NF1-gen. Obwohl insgesamt selten und tritt in etwa einer von 3.000 Menschen, es ist eine der häufigsten so genannten genetischen Syndromen. Etwa die Hälfte aller Fälle sind vererbt.
Menschen mit NF1 haben eine Vorrichtung zu entwickeln, die mehrere Tumoren im Gehirn und an den peripheren Nerven im ganzen Körper, nur unter die Haut, und auch prädisponiert form seltener Tumoren des Magen-Darm-Trakt, Nebenniere und andere weiche Gewebe. Insgesamt ist die Anzahl der Tumoren pro patient variiert stark, von einigen bis zu Hunderten im Laufe Ihres Lebens. Während die meisten wachsen langsam (low-grade) und gutartig, einige gutartigen peripheren Nerven Tumoren (neurofibromas) entwickeln in so genannten malignen peripheren nervenscheidentumore (MPNST), die metastasieren Häufig, sind schwierig zu behandeln und sind eine der Hauptursachen des Todes bei Patienten mit NF1.
Im Laufe der Zeit, Rodriguez sagte, er bemerkte, dass viele der high-Qualität, aggressive NF1-Tumoren, die er untersucht wurden, fehlt das ATRX-protein, ist ein Verlust im Zusammenhang mit einer Krebs-spezifischen biologischen Prozess namens ALT, kurz für alternativen Verlängerung der Telomere. Co-investigator Christopher Heaphy, Ph. D., ALT-Expertin und assistant professor der Pathologie und der Onkologie an der Johns Hopkins Universität, erklärt, dass am Ende jedes Chromosom in einem Zellkern, eine Sequenz von sechs DNA – „Buchstaben“ wiederholt sich bis zu 2.000 mal, um die form eines so genannten telomere. „Telomere sind wie die Kunststoff-Kappen an den enden der Schnürsenkel“, sagt er. „Sie schützen die Chromosomen von ausfransen oder immer Durcheinander.“
Bevor sich eine Zelle teilt, muss es eine Duplizierung der Chromosomen, die zusammen mit Ihrer Telomere, aber die Spitzen der Telomere können nicht repliziert werden. So ein paar Dutzend DNA-Briefe gehen verloren, jedes mal, wenn eine Zelle sich teilt, so dass die Telomer-Länge stand-in für das Alter einer Zelle, sagt Heaphy.
Da Krebszellen teilen sich häufiger als die meisten gesunden Zellen, die Ihre Telomere verkürzen, mehr schnell, setzen Sie die Zelle in Gefahr, chromosomale Instabilität, Zelltod und „genomische Katastrophe“, sagt Heaphy. Um dies zu bekämpfen, die meisten Krebszellen schalten Sie ein spezielles Enzym, die sogenannte telomerase, pflegen Sie die Länge Ihrer Telomere. (Carol Greider, Ph. D., der Daniel-Nathans-Professur und Direktor der Molekularen Biologie und Genetik an der Johns Hopkins, gewann 2009 den Nobelpreis in Physiologie oder Medizin für Ihre Entdeckung der telomerase.)
„Eine Teilmenge von Krebserkrankungen, jedoch nicht die Aktivierung der telomerase jedoch die ALT-Mechanismus statt“, sagt Heaphy. ALT nutzt die Homologe Rekombination, eine Art von Austausch von genetischem material, zur Verlängerung der Telomere, aber wie genau dies geschieht, bleibt unter Untersuchung.
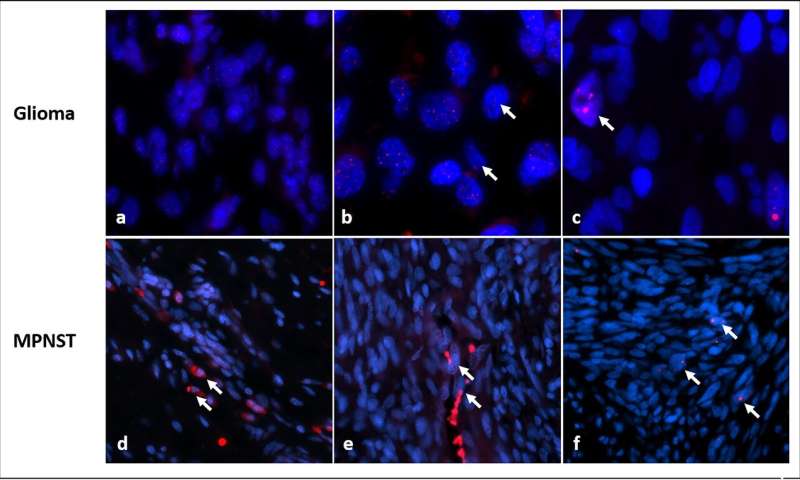
Zur Beurteilung der Bedeutung von ALT in NF1-Tumoren, Rodriguez, Heaphy und Kollegen verwendeten fluoreszierenden Sonden, beleuchtet die Telomere zu untersuchen 426 tumor Proben von 256 Patienten mit NF1.
Insgesamt, ALT-wurde festgestellt, in 23 NF1-assoziierten Tumore (32.9%). Der ALT-positiven Tumoren, 14 (60%) waren high-grade, oder aggressive Tumoren, während nur 9 von 47 low-grade-Gliomen (19%) waren ALT positiv.
Unter den 99 MPNST Proben, 93 entwickelt, in der Patienten bekannt NF1. ALT war in 15 von 148 (17%) Patienten, aber ALT war Sie fast völlig abwesend von der 77 neurofibromas studiert und alle anderen selteneren Tumoren (46), mit Ausnahme von zwei Fällen, die beide bösartig.
„Die Daten zeigen, dass ALT ist in der Regel—wenn auch nicht immer—verbunden mit mehr aggressive Tumoren bei Patienten mit NF1“, sagt Rodriguez. „Es ist auch wahrscheinlicher, in Gliomen als MPNSTs.“
Mit dem gleichen assay, das team auch bewertet Zellen aus Tumoren, die waren ALT-negativ. Sie beurteilten die insgesamt Telomer-Längen und verglichen Sie mit denen in den nicht-krebsartigen Zellen innerhalb der gleichen Probe, und dann erzielte so kurz, normal oder lang.
In der 183-ALT-negative neurofibromas bewertet, alle die Telomer-Längen wurden als normal angesehen. Durch Kontrast, normal Telomere wurden nur 57% und 50%, die der 30 ALT-negative Tumore und 30 ALT-negative MPNSTs getestet. Während sich verändert telomerlängen verbreitet waren, abnorme Telomere tendenziell zu lange in Gliomen (40%), und zu kurz, in MPNSTs (47%).
Rodriguez sagt, dass diese Unterschiede könnten klinisch angewendet werden, um vorherzusagen, tumor-Aggressivität, aber er warnte, dass die Unterschiede könnten auch Stammzellen von Variationen im Alter der Patienten, die Tatsache, dass standard-Telomer-Längen unterscheiden sich in verschiedenen Zelltypen, den Zeitpunkt der telomerase-Aktivierung, oder etwas anderes. Größere Studien notwendig sind, fügt er hinzu, um auszuschließen, die möglicherweise verfälschender Faktoren.
Endlich, die Wissenschaftler analysierten die Zusammenhänge zwischen der Telomer-Veränderungen und die überlebensrate der Patienten. Patienten mit einem Gliom überlebten länger, wenn Sie wurden ALT-negative, auch wenn die Anpassung für Alter und Rang, zwei wichtige Faktoren, die den Ausgang im Gehirn-Tumoren. Für Patienten mit MPNSTs es gab keinen statistisch signifikanten Unterschied zwischen jenen, die ALT-positiv oder negativ. Jedoch, unter die ganze Gruppe von MPNSTs, die Forscher festgestellt, dass kurze Telomere erschien einen signifikanten überlebensvorteil, eine zu finden, die Sie als „widersprüchlich“ und das bleibt unerklärt.