Hemlibra möglicherweise ohne Packungsbeilage

In einem Rote Hand Brief werden Apotheker:innen dazu aufgerufen, Faltschachteln von Hemlibra (Emicizumab) vor der Abgabe zu überprüfen. Aufgrund von Problemen bei der Verpackung könnte bei einzelnen Packungen mancher Chargen die Packungsbeilage fehlen.
Bei der Roche Pharma AG hat es Probleme bei der Sekundärverpackung von Antikörpern gegeben. Bereits im April 2023 stellte der Hersteller ein Automatisierungsproblem im Verpackungsprozess von Tecentriq® (Atezolizumab) fest. Infolgedessen fehlte in zwei Faltschachteln die Packungsbeilage. Da Hemlibra® (Emicizumab) auf derselben Anlage verpackt wurde, kann der Hersteller nicht ausschließen, dass es auch hier zu Fehlern gekommen sein könnte. In einem Rote Hand Brief bittet der Hersteller Angehörige der gesundheitsberufe daher um Mithilfe zur Sicherung der Patientensicherheit.
Kurzsteckbrief Emicizumab
Bei Emicizumab handelt es sich um einen chimären, bispezifischen, humanisierten monoklonalen Antikörper, der an die Gerinnungsfaktoren IXa und X bindet und somit deren Aktivierung vermittelt. Beide Faktoren werden üblicherweise durch Gerinnungsfaktor VIII aktiviert. Patient:innen mit Hämophilie-A weisen einen Mangel an Faktor VIII auf, sodass Emicizumab hier bei mittelschweren bis schweren Erkrankungen oder bei Vorliegen von Faktor VIII-Hemmkörpern zur Routineprophylaxe von Blutungsereignissen zugelassen ist.
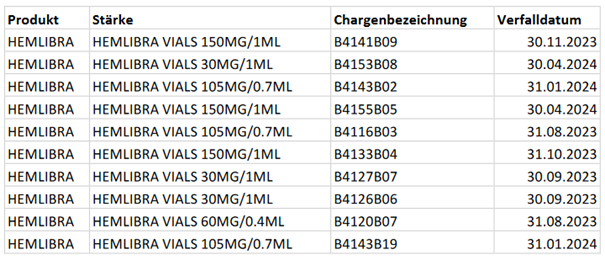
Betroffen sind hierbei folgende Chargen, die zwischen dem 15. November 2021 und dem 24. April 2023 hergestellt wurden:
Zwar habe es seit der Inbetriebnahme der Anlage im November 2021 noch keine entsprechenden Beanstandungen gegeben, sollte das Apothekenpersonal jedoch eine Schachtel ohne Packungsbeilage identifizieren, bittet Roche dieses:
- Patient:innen zu informieren, dass kein Qualitätsmangel am Produkt vorliegt.
- Die Packungsbeilage online abzurufen, auszudrucken und den Anwendern auszuhändigen. Abrufbar ist die Packungsbeilage etwa unter https://www.roche.de/arzneimittel/von-a-z.
- Das betroffene Produkt bei der Kontaktstelle (Medical Information Team) des Herstellers zu melden. Diese ist über die Telefonnummer (07624) 14-2015 (Mo-Fr 9 –18 Uhr) zu erreichen, ebenso über die Homepage.
Mehr zum Thema

DAZ Fresh-up Hämophilie
Wenn das Blut nicht gerinnt
EMA-Empfehlung
Bedingte Zulassung für erstes Gentherapeutikum gegen Hämophilie A
Seit dem 24. April 2023 kontrolliert Roche zusätzlich alle verpackten Schachteln mittels Waage auf das Vorhandensein der Packungsbeilage.
Den vollständigen Rote Hand Brief finden Sie hier.
Quelle: Den ganzen Artikel lesen