Diabetes-Medikament metformin zeigt Versprechen in der Maus-Studie für eine Allgemeine Art von ALS


Eine von der FDA zugelassene diabetes-Medikament zeigt frühe Anzeichen von Versprechen, gegen die häufigste genetische form der amyotrophen Lateralsklerose, eine verheerende neurologische Erkrankung, die zu Lähmungserscheinungen.
Die ALS ist eine progressive Erkrankung, die Auswirkungen auf Nervenzellen im Gehirn und Rückenmark. Motor Neuronen Signale übertragen von unserem Gehirn, unsere Muskeln und lassen uns zu bewegen. ALS Ursachen dieser motorischen Neuronen sterben, was den Verlust eines Patienten Fähigkeit zu sprechen, Essen, bewegen und atmen. Bemerkenswerter ALS-Patienten gehören die New York Yankees baseball-star Lou Gehrig (die Krankheit wird oft als Lou Gehrig-Krankheit), der Physiker Stephen Hawking und New Orleans Saints-football-star Steve Gleason. Derzeit gibt es mehr als 30.000 Fälle von ALS in den Vereinigten Staaten, und die Durchschnittliche Lebenserwartung nach der Diagnose ist in der Regel 2 bis 5 Jahre. Es gibt derzeit keine Heilung für ALS.
Ich bin ein Wissenschaftler, der Studien zu neurologischen Erkrankungen, die in Familien laufen, und ich habe hart gearbeitet, eine Behandlung zu finden, zu stoppen, ALS. Unser team hat eine Entdeckung gemacht, detailliert in einer wissenschaftlichen Studie, dass ebnet den Weg für die weitere Forschung zur Verbesserung der Krankheit in einem genetischen Typ der ALS verursacht durch eine mutation in einem gen mit dem sperrigen Namen chromosome 9 open reading frame 72 (C9orf72), basierend auf seiner Lage auf dem Chromosom 9. Neben ALS, Mutationen in diesem gen können auch Ursache frontotemporale Demenz, die kann dazu führen, Apathie, Verlust der emotionalen Kontrolle und kognitiven Fähigkeiten. Einige Patienten mit der C9orf72-mutation entwickeln ALS, andere entwickeln frontotemporale Demenz, und einige entwickeln die beiden. Zusammen, diese Krankheiten sind nachfolgend C9-ALS/FTD.
Wiederholendes Thema bei ALS und anderen neurodegenerativen Erkrankungen
Ich habe der Schwerpunkt auf der C9-ALS, das ist die häufigste genetische Typ von ALS die wird verursacht durch eine mutation im C9orf72-gen. Die mutation tritt auf, wenn sechs Buchstaben der DNA, die zum Teil auf die gene, die genetischen code—GGGGCC—wiederholt werden Hunderte von zusätzlichen Zeiten. Es ist, als wenn ein einzelnes Wort wiederholt sich hundert mal den gleichen Satz.
Die gen-mutation, die bewirkt, C9-ALS Teil einer viel größeren Familie von Erkrankungen, die durch ähnliche Erweiterungen von kurzen, wiederholten DNA-Segmente.
Wiederholen Sie die Erweiterung Mutationen entdeckt wurden Sie erst im Jahr 1991, als die Ursache des Fragilen-X-Syndrom bulbäre und Spinale Muskelatrophie, und diese Art von mutation ist nun bekannt, dass mehr als 50 verschiedene neurologische Erkrankungen.
Im Laufe der vergangenen 30 Jahre, habe ich Studium dieser Arten von ausbau-Mutationen, einschließlich derjenigen, die zu einer Krankheit namens spinocerebelläre Ataxie Typ 8 betrifft die Koordination und der Muskel-Krankheit myotonic dystrophy type 2. Ich war besonders daran interessiert, zu verstehen, wie diese gen-Mutationen arbeiten, und es gab einige große überraschungen.
Eine mutation, zwei RNAs und sechs unerwartete Proteine
Typischerweise wird ein gen in der DNA kodiert, macht eine einzelne Kopie von einem zwischengeschalteten Molekül namens RNA, die die Zelle benutzt, die zur Herstellung eines proteins. Auch Teile von Genen sind in der Regel nicht zum Ausdruck, die als Proteine. Die repeat-expansion-mutation in C9-ALS und vielen anderen neurologischen Erkrankungen tritt in dieser gen-Regionen nicht zu erwarten, dass Proteine zu produzieren. Aber, wenn einer repeat-expansion vorhanden ist, die mutierte region produziert bis zu sechs unerwartete und toxische Proteine.
Im Jahr 2006 haben wir begonnen, zu entwirren, wie das geschieht, indem Sie entdecken, dass die spinocerebelläre Ataxie Typ 8 repeat-expansion mutation erzeugt zwei RNAs statt nur einer. Diese Doppel-den-ärger-Szenario war auch in myotonic Dystrophie Typ 1 und jetzt bekannt ist, treten für viele repeat-expansion-Erkrankungen.
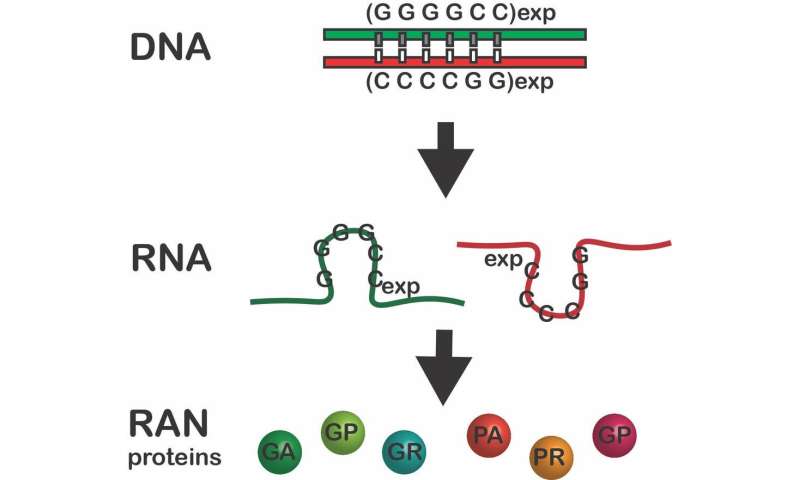
Im Jahr 2011 entdeckten wir, dass diese repeat-expansion-Mutationen auch brechen die zuvor festgelegten dogma, dass ein start-signal eingebettet in den genetischen code, der erforderlich ist, um Proteine zu bilden. Im Gegensatz dazu haben wir gezeigt, dass, wenn einer repeat-expansion-mutation vorhanden ist, werden Proteine produziert werden, ohne dass ein start-signal und zusätzliche, unerwartete Proteine gemacht werden – bis zu sechs für jede Erweiterung mutation.
Wir nannten diese Schurken-Proteine, wiederholen Sie die verbundenen nicht-AUG (RAN) – Proteine. Diese Proteine akkumulieren in den Nervenzellen und anderen Zellen des Gehirns, Sie zu beschädigen und verursacht die Krankheit. RAN-Proteine sind nun gefunden worden in 10 verschiedenen repeat-expansion Erkrankungen, darunter Chorea Huntington und Fragiles-X-tremor-Ataxie-Syndrom.
Im C9-ALS-Mäusen haben wir gezeigt, dass die Zerstörung RAN-Proteine mithilfe von Antikörpern in den Mäusen verbessert die Lebensdauer, die überlebensrate von Motoneuronen und andere wichtige Aspekte der Krankheit.
In der neu veröffentlichten Studie in den Proceedings of the National Academy of Sciences, unser team entdeckt zellulären Schalter, der, wenn eingeschaltet, entführt die Zelle und zwingt Sie, in die RAN-Proteine. RNA-Kopien der ausbau Mutationen schalten Sie diesen Schalter aufgerufen, die protein-kinase R Weg.
Ausschalten der protein-kinase R-Weg switch-Blöcke LIEF protein-Produktion für mehrere Arten von Krankheit-verursachenden wiederholen Sie die Erweiterungen, wodurch die protein-kinase R eine mögliche Achillesferse für das RAN protein Krankheiten. Diese Ergebnisse hatten mich und meine Kollegen Tao Zu, ein Forschungs-Assistent professor, enorm aufgeregt.
Metformin zeigt Versprechen für C9-ALS/FTD und andere Erweiterung Krankheiten
Ich beschlossen, dass wir testen, der von der FDA zugelassene diabetes-Medikament metformin nach Anhörung Nahum Sonenberg, ein langjähriger Mitarbeiter, Gegenwart Daten, die zeigen, dass dieses Medikament verbessert die Krankheit in Mäusen, die mit dem Fragilen-X-Syndrom, einer Krankheit, die mit einem fehlenden protein. Obwohl das Fragile-X-stört die protein-Produktion in einer ganz anderen Weise, ich dachte, dass da metformin normalisiert protein-Produktion in Fragilen-X-Syndrom, vielleicht könnte das gleiche tun, für das RAN protein Krankheiten.
Obwohl es ein langer Schuß war, fragte ich Dr. Zu testen metformin in Zellen, um zu sehen, wenn das Medikament senken würde, LIEF der protein-Ebene. Die Ergebnisse in den Zellen sehr deutlich gezeigt, dass Sie es Tat. Wir gingen auf zu zeigen, dass metformin hemmt die protein-kinase R, reduziert die RAN-Proteine und verbessert die Krankheit in C9-ALS/FTD-Mäuse. Es ist wichtig zu betonen, dass dieser Ansatz ist gedacht, um für diese Besondere genetische form der ALS und frontotemporalen Demenz, weil das C9orf72 – mutation macht die RAN-Proteine. In einer früheren Studie von einer anderen Gruppe, metformin-Behandlung nicht wirksam war in Mäusen, die mit einer anderen form von ALS, die nicht produzieren, RAN-Proteine.
In der Regel dauert es ein Jahrzehnt oder mehr zu bewegen, viel versprechende Forschung aus dem Labor in die Klinik. Metformin eingeführt wurde 1957 in Frankreich und genehmigt im Jahr 1995 in den Vereinigten Staaten. Weil metformin ist weit verbreitet als eine sichere und wirksame Behandlung für Typ-2-diabetes mit wenigen Nebenwirkungen, das können wir überspringen die mühsame drug-development-Prozess und-sofort testen, ob der nutzen der metformin-Behandlung bei Mäusen finden sich auch bei Menschen mit C9-ALS.
Meine Kollegen und ich an der Universität von Florida haben bereits begonnen, eine Phase-2-open-label-Studie zur Prüfung der Wirkung von metformin in C9-ALS-Patienten. In diesem ersten open-label-Studie, in die jeder erhalten dem Medikament, wir werden testen, um zu sehen, ob das Medikament sicher ist für Patienten mit C9-ALS und wenn es senkt LIEF der Proteingehalt im Liquor.