Abschneiden von Nieren-Krebs auf seine Wurzeln

Wissenschaftler am MDC haben entdeckt, Stammzellen, verantwortlich für die häufigste form von Nierenkrebs. Das team von Walter Birchmeier hat einen Weg gefunden, zu blockieren das Wachstum von Tumoren in drei Modellen der Krankheit.
Nicht alle Krebszellen gleich sind. Tumoren enthalten potente Krebs-Stammzellen produzieren, die Metastasen und regenerieren kann die Krankheit, wenn Sie entkommen eine Behandlung. Das macht Sie vitaler Ziele für Therapien, wenn Wissenschaftler können Sie isolieren und untersuchen Ihre Schwächen. Aber die Zellen sind oft so selten, dass Sie noch gefunden werden, um viele Arten von Krebs.
Professor Walter Birchmeier ‚ s Labor am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) in Zusammenarbeit mit der Urologie-Abteilung der Charite, hat nun entdeckt, Krebs-Stammzellen verantwortlich für die häufigste form von Nierenkrebs: clear cell renal cell carcinoma, oder ccRCC. In eine Berlin-weite Zusammenarbeit, die die Wissenschaftler fanden eine Schwäche. Die Zellen richten sich auf zwei wichtige biochemische Signale. Blockieren Sie beide behindert das Wachstum von Tumoren in mehreren Labor-Modelle der Krankheit, was auf einen vielversprechenden neuen Ansatz zur Behandlung von menschlichen Patienten. Die Studie erscheint in der aktuellen Ausgabe von „Nature Communications“ und umfasst Autoren aus dem MDC, die Urologie-Abteilung der Charite Berlin, dem Berlin Institute of Health (BIH), der Screening-Einheit des FMP Leibniz-Institut, der Firma EPO und anderen Partnern.
Zwei biochemische Schwächen
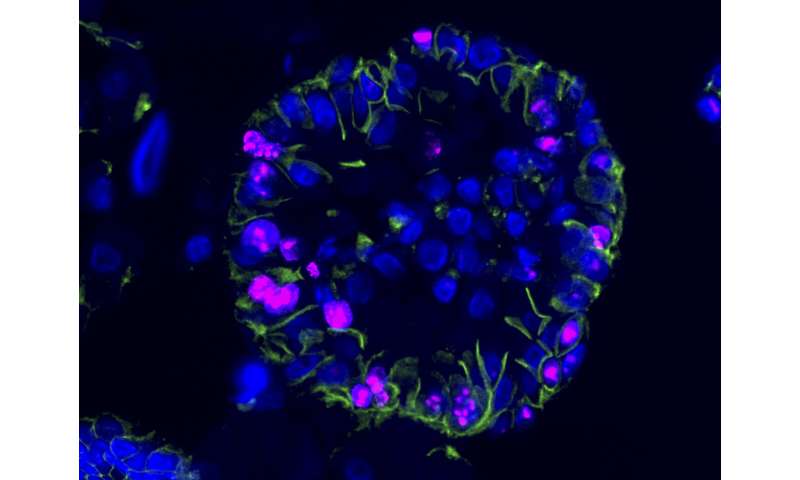
Identifizierung von ccRCC KrebsStammzellen entscheidend für das Projekt. Dr. Annika Fendler, postdoc in der Birchmeier-Gruppe und Mitglied der Charite Urologie-Abteilung, war der erste Autor auf dem Papier. Sie identifizierte drei Proteine auf den Oberflächen der Zellen, die aktiviert werden markiert und anschließend isoliert. Dies erlaubt Dr. Hans-Peter Rahn zur Isolierung der Zellen mittels Fluoreszenz-aktivierter zellsortierung (FACS). Die Wissenschaftler fanden heraus, dass Krebs-Stammzellen entfielen nur etwa 2% der insgesamt in der menschlichen Tumoren.
„Unsere Analyse dieser Zellen zeigt, von denen Sie abhängen Signale an zwei biochemische Netzwerke genannt, WNT und NOTCH,“ Fendler sagt. Da diese Netzwerke bekannt waren, um Rollen zu spielen, die in anderen Arten von Krebs, Labor gelernt hat, stören Sie. Hatten Sie bereits entwickelt, ein potenter inhibitor der WNT-Signale mit dem FMP, Ihre partner-institute auf dem campus.
Zuvor eine Rolle für die WNT-und NOTCH hatte nicht vermutet, in Nierentumoren; Mutationen in diesen Netzwerken selten in die Krankheit. Beide Signale sind jedoch, im Zusammenhang mit einem tumor-suppressor-gen namens VHL, die stark im Zusammenhang mit ccRCC. Die neuen Ergebnisse zeigten, dass die Blockierung der WNT -, NOTCH-oder beide Signale könnte Ziel der Krebs-Stammzellen und interferieren mit den meisten aggressiven Komponenten der Tumoren.
In der Klinik, Inhibitoren gegen verschiedene biochemische Stoffwechselwege ersetzen zunehmend der Chemotherapie-Behandlungen für Krebs-Patienten. „Aber Sie müssen wissen, welche Pfade zum Ziel „“ Fendler, sagt, „und nicht genug, wurde bekannt, über die Biologie von ccRCC.“
Das Versprechen von mehreren Modell-Systeme
Erste tests der neuen Inhibitoren waren vielversprechend. „Bemerkenswert ist, dass drei Viertel von Zell-Kulturen, die aus der Patienten reagierten auf mindestens eine Art von inhibitor und 50 Prozent der rest gehemmt waren, in Anwesenheit der beiden Inhibitoren“, sagt Birchmeier.
Aber hier ist das Labor konfrontiert, die eine der größten Herausforderungen der Krebsforschung. „Was wir lernen, im Labor ist in der Regel sehr schwierig zu übersetzen, in den realen Kontext eines Patienten“, sagt Birchmeier. „Regelmäßige Zell-Linie, Kulturen und Tier-Modellen, die von anderen Laboren nicht reflektieren, die Komplexität von Krankheit im Körper einer person.“ Eine Lösung ist die Entwicklung weitere Arten von Modellen, die näher an der menschlichen Krankheit.
Birchmeier und seine Kollegen waren bereits geübt im extrahieren von Krebs-Stammzellen von Patienten, wächst Sie in Kulturen und forderte Sie mit einer riesigen palette von Medikamenten. In Zusammenarbeit mit der Firma EPA nach Berlin-Buch campus, Sie haben auch transplantierte Patienten “ Krebs-Stammzellen in Mäusen, die Tumoren entwickeln praktisch identisch mit denen Ihrer menschlichen Kollegen. Diese Tiere sind unerlässlich bei der Suche nach Therapien: was heilt einen menschlichen tumor in Mäusen könnte auch in einem Patienten. In dem aktuellen Projekt, EPO injiziert WNT-und NOTCH-Inhibitoren, einzeln und und-Kombinationen, die in tumor-tragenden Mäusen und beobachteten, was geschah. Die Blockierung der beiden Signale erwies sich als die effektivste Strategie. Aber würde es funktionieren ebenso gut in Menschen?
Eine neue Art von Modell
Vor kurzem haben Wissenschaftler gelernt zu verwenden, Patienten Zellen zu generieren, die organoids: Miniatur-Versionen der Organe, die mit vielen Arten von Zellen. Sie bestehen aus menschlichem Gewebe, aber kann verwendet werden, ohne die ethischen Probleme der Prüfung von Drogen auf den menschlichen Patienten. Organoids bereits erstellt, für gesunde Nieren, den verschiedenen Organen und Tumoren wie Darmkrebs.
„Andere Gruppen hatten versucht, mit ccRCC, hatte aber weniger erfolgreich gewesen,“ Fendler sagt. „Das Gewebe nicht wachsen sehr gut oder nicht produzieren organoids. Diese beiden Faktoren sind wichtig bei der Entwicklung von Modellen für Drogen-Tests und-Behandlungen. Ein patient, der die Krankheit braucht die schnelle und zuverlässige Modelle, die auf die Behandlung Antworten getestet werden können.“
Andere Modelle, ähnliche Ergebnisse
„Die wichtigste Erkenntnis aus der Studie,“ Birchmeier sagt, „erkannt zu haben, ist die wichtige Rolle von WNT-und NOTCH-Systeme in ccRCC und zu zeigen, dass die Hemmung einen Einfluss auf die Tumoren.“ Es bleiben die feinen Unterschiede zwischen den Modell-Systeme, die noch erforscht werden müssen; in dem moment, Studien von Mäusen, die noch benötigt werden.